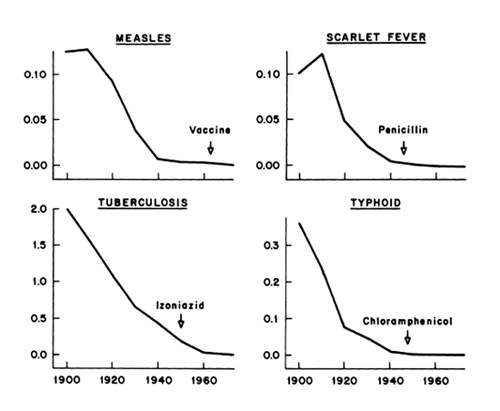
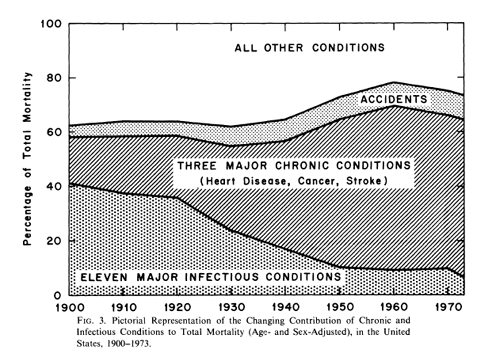
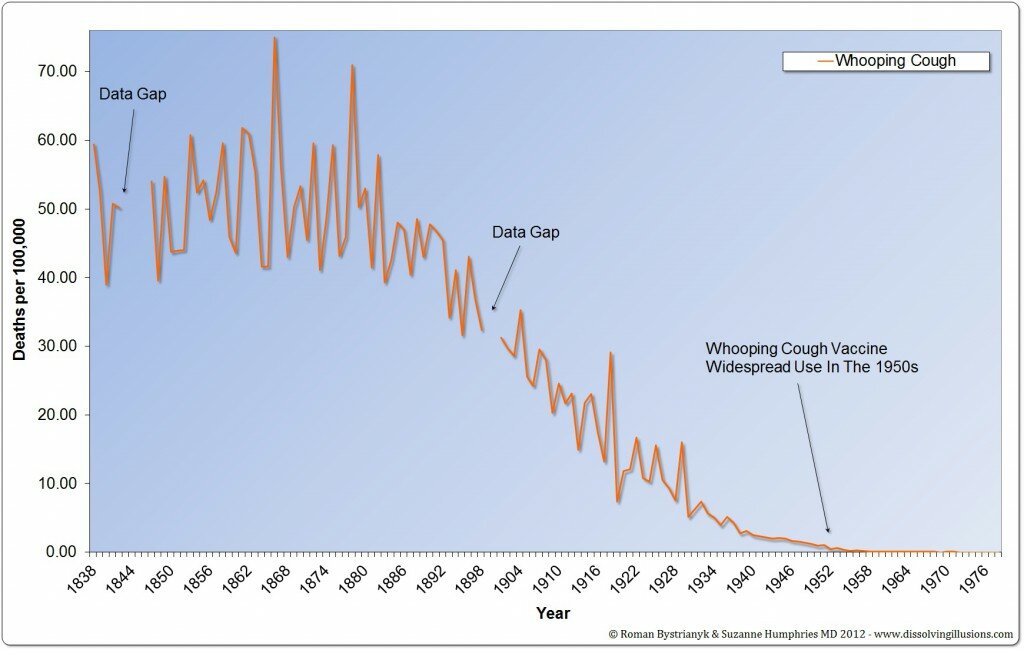
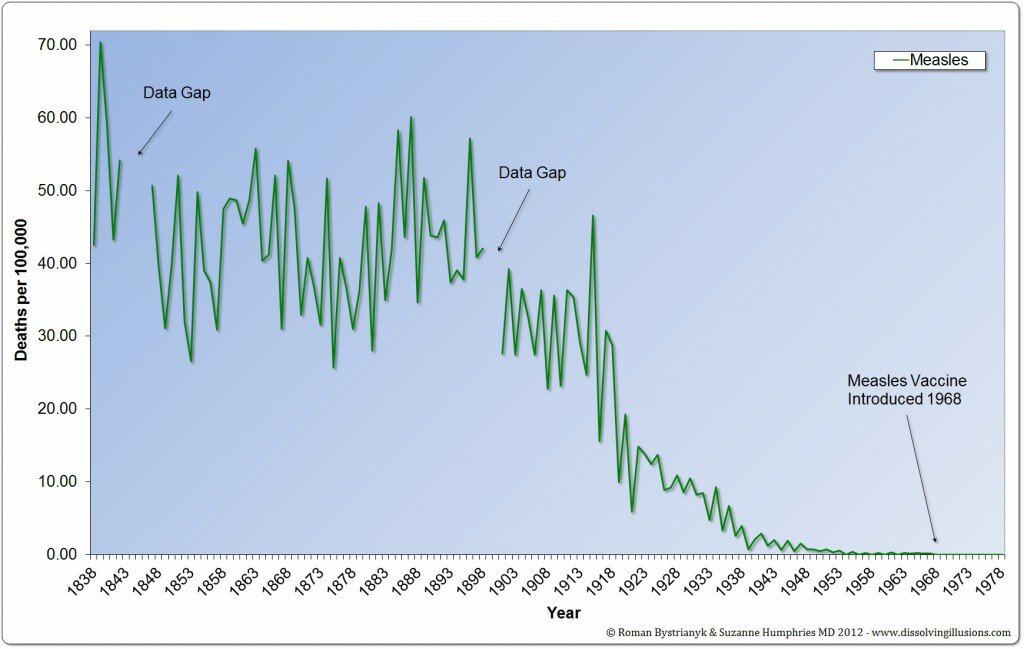
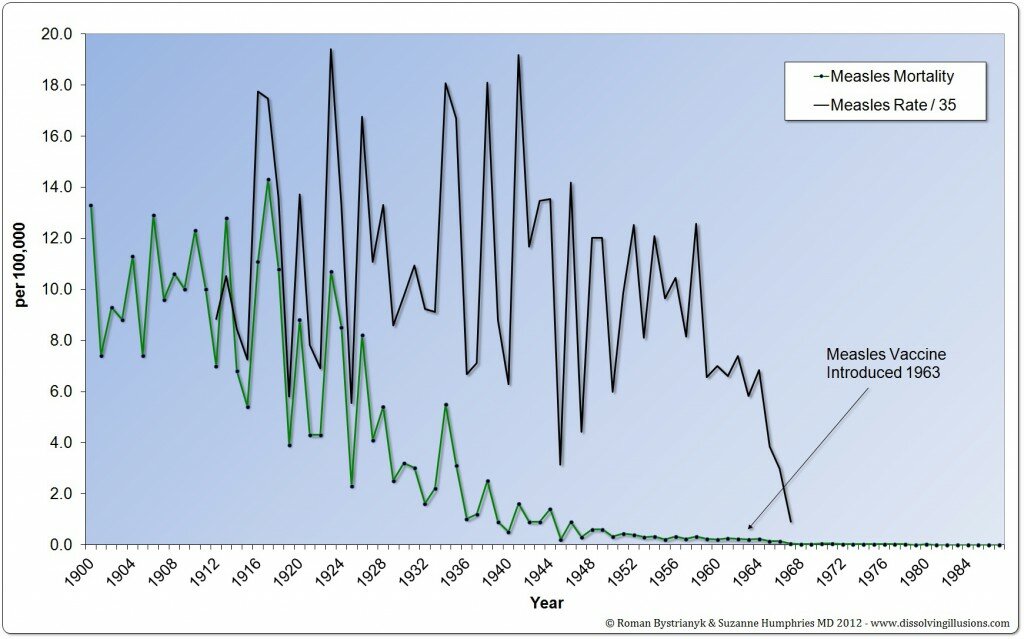
I medici non sono più multati per la mancata segnalazione di reazioni avverse, come previsto dalla riforma per la farmacovigilanza voluta dall’ex Ministro Girolamo Sirchia, il quale aveva cancellato, ogni sanzione per i medici che si rifiutano di fare segnalazioni di evento avverso dopo somministrazione di farmaci e vaccini.
OBBLIGO DI SEGNALAZIONE REAZIONI AVVERSE
E’ possibile scaricare il modulo per la denuncia di reazione avversa a vaccino per i semplici cittadini oppure scaricarlo all’indirizzo:
- http://www.agenziafarmaco.gov.it/sites/default/files/tipo_file07d6.pdf
Se invece aveste un medico/pediatra disposto a compilarlo allora il modulo sarebbe reperibile a questo indirizzo:
- http://www.agenziafarmaco.gov.it/sites/default/files/tipo_filecb84.pdf
Ricordo inoltre che possono essere considerate reazioni avverse a vaccino, anche in considerazione della loro entità:
– Anafilassi
– Episodi sincopali
– Crisi di ansia
– Reazioni locali (ponfo nel luogo dell’inoculo, dermatiti etc.)
– Febbre persistente superiore a 38,5°
– Pianto ininterrotto
– Perdita del sonno (oppure frequenti risvegli durante lo stesso, spesso associati a pianto)
– Problemi neurologici
– Problemi gastrointestinali
-. Bruschi ed immotivati cambiamenti caratteriali e nei comportamenti, perdita del contatto oculare etc.
Le vaccinazioni possono dar luogo ad eventi a rapida o a lenta insorgenza:
EVENTI A RAPIDA INSORGENZA
1. Spasmi respiratori (affettivi o di singhiozzo)
Episodio tipico nei lattanti e nei bambini piccoli (si verificano nel 5% dei bambini tra i 6 mesi e i 5 anni), di solito scatenato da un evento quale uno spavento, un dolore.
Dopo una fase più o meno lunga di pianto intenso, il bambino sospende il respiro in fase espiratoria e appare manifestamente agitato. Si osserva un rossore del viso, e una cianosi peribuccale, che tende ad intensificarsi per tutta la durata della crisi.
Se persiste più a lungo può esserci una breve perdita di coscienza o anche un irrigidimento in opistotono o delle mioclonie isolate.
2. Crisi d’ansia
Le persone in preda a crisi d’ansia possono apparire impaurite, pallide, sudano abbondantemente e si lamentano di stordimenti, vertigini, nodo alla gola, prurito a livello del viso e delle estremità.
In genere vi è una evidente iperventilazione.
3. Svenimento – collasso
Episodio caratterizzato da pallore, sudorazione profusa, ipotensione, senso di vertigine, perdita della coscienza.
In circa un quarto dei casi si verificano movimenti tonico–clonici (crisi convulsive o epilettiche) in genere agli arti.
Il polso centrale è presente, anche se debole e bradicardico a differenza di quello che si verifica in caso di shock anafilattico.
Respirazione rallentata o con apnee di pochi secondi, a differenza di quello che si verifica in caso di crisi d’ansia.
L’episodio può causare caduta e conseguente trauma.
4. Episodio di ipotonia-iporesponsività (HHE)
Episodio caratterizzato da diminuzione o perdita acuta del tono muscolare, accompagnato da pallore, o cianosi, o mancata risposta agli stimoli ambientali, o torpore prolungato
Può essere preceduto da irritabilità o febbre.
Si verifica 1-24 ore dopo la vaccinazione, eccezionalmente dopo alcuni minuti.
5. Manifestazioni di ipersensibilità immediata (anafilassi)
Eruzione orticarioide e/o a un rigonfiamento immediato nel punto di iniezione o quando, pur essendovi il coinvolgimento di altri sistemi o apparati non si hanno turbe funzionali importanti (es: starnuti, lacrimazione, tosse, vampate vasomotorie, prurito, broncospasmo lieve, angioedema di Quinke…)
Grave: quando predominano i sintomi cardiorespiratori e neurologici fino allo stato di shock con ipoperfusione grave da ipovolemia relativa, con o senza broncospasmo e/o laringospasmo o edema della glottide.
EVENTI AD INSORGENZA LENTA O LUNGO LATENTI
Sono quegli eventi che rimangono a lungo latenti ovvero che insorgono a distanza di tempo – giorni, mesi o addirittura anni – oppure che, pur essendo insorti, per lungo tempo non danno luogo a segnali della loro presenza.
Tra questi tutte le patologie autoimmuni.
Con il D.L. 95/03, che ha modificato in parte il D.L. 44/97, sono state abolite le sanzioni penali derivanti dalla mancata segnalazione di sospetta ADR.
(http://www.camera.it/parlam/leggi/deleghe/03095dl.htm)

Decreto Legislativo 8 aprile 2003, n. 95
“Attuazione della direttiva 2000/38/CE relativa alle specialità medicinali”
pubblicato nella Gazzetta Ufficiale n. 101 del 3 maggio 2003
IL PRESIDENTE DELLA REPUBBLICA
Visti gli articoli 76 e 87 della Costituzione;
Vista la direttiva 2000/38/CE della Commissione, del 5 giugno 2000, che modifica il capitolo V-bis – Farmacovigilanza – della direttiva 75/319/CEE del Consiglio, concernente il riavvicinamento delle disposizioni legislative, regolamentari ed amministrative relative alle specialita’ medicinali;
Vista la legge 1° marzo 2002, n. 39, ed in particolare l’allegato A;
Visto il decreto legislativo 18 febbraio 1997, n. 44;
Visto il decreto legislativo 29 maggio 1991, n. 178;
Visto il decreto del Presidente della Repubblica 7 dicembre 2000, n. 435, recante norme di organizzazione del Ministero della sanita’;
Vista la preliminare deliberazione del Consiglio dei Ministri, adottata nella riunione del 12 marzo 2003;
Acquisito il parere della Conferenza permanente per i rapporti tra lo Stato, le regioni e le province autonome di Trento e di Bolzano;
Vista la deliberazione del Consiglio dei Ministri, adottata nella riunione del 4 aprile 2003;
Sulla proposta del Ministro per le politiche comunitarie e del Ministro della salute, di concerto con i Ministri della giustizia, dell’economia e delle finanze, degli affari esteri e per gli affari regionali;
Emana il seguente decreto legislativo:
Art. 1.
1. Al decreto legislativo 18 febbraio 1997, n. 44, sono apportate le seguenti modificazioni:
a) l’articolo 2 e’ sostituito dal seguente:
«Art. 2. – 1. Il sistema nazionale di farmacovigilanza fa capo alla Direzione generale per la valutazione dei medicinali e per la farmacovigilanza del Ministero della salute, di seguito denominato “Direzione”.
2. La Direzione, senza oneri aggiuntivi a carico del bilancio dello Stato, conformemente alle modalita’ eventualmente concordate a livello comunitario e definite dall’Agenzia europea per la valutazione dei medicinali – EMEA – di seguito denominata “Agenzia”:
a) raccoglie e valuta informazioni utili per la sorveglianza dei medicinali con particolare riguardo alle reazioni avverse, all’uso improprio, nonche’ all’abuso degli stessi tenendo conto anche dei dati relativi ai consumi dei medesimi;
b) promuove il processo di informatizzazione di tutti i flussi di dati necessari alla farmacovigilanza gestendo e coordinando, in particolare, la rete telematica nazionale di farmacovigilanza, che collega le strutture sanitarie, le regioni e le aziende farmaceutiche. Collabora altresi’ con l’Agenzia, con i competenti organismi degli Stati membri e con la Commissione europea alla costituzione ed alla gestione di una rete informatizzata europea per agevolare lo scambio delle informazioni inerenti la farmacovigilanza dei medicinali commercializzati nella Comunita’ europea per consentire a tutte le autorita’ competenti di condividere le informazioni simultaneamente;
c) promuove e coordina, anche in collaborazione con l’Istituto superiore di sanita’ studi e ricerche di farmacoutilizzazione, farmacovigilanza attiva e farmacoepidemiologia;
d) adotta, coadiuvata dalle regioni, iniziative atte a promuovere le segnalazioni spontanee da parte degli operatori sanitari;
e) promuove iniziative idonee per la corretta comunicazione delle informazioni relative alla farmacovigilanza ai cittadini ed agli operatori sanitari;
f) provvede, in collaborazione con la Commissione unica del farmaco e il Consiglio superiore di sanita’, a predisporre la relazione annuale al Parlamento sulla farmacovigilanza.
3. Le regioni, singolarmente o di intesa fra loro, collaborano con la Direzione nell’attivita’ di farmacovigilanza, fornendo elementi di conoscenza e valutazione ad integrazione dei dati che pervengono alla Direzione ai sensi dell’articolo 4. Le regioni, inoltre provvedono, nell’ambito delle proprie competenze, alla diffusione delle informazioni al personale sanitario ed alla formazione degli operatori nel campo della farmacovigilanza. Le regioni collaborano inoltre a fornire i dati sui consumi dei medicinali mediante programmi di monitoraggio sulle prescrizioni dei farmaci a livello regionale. Le regioni si possono avvalere per la loro attivita’ anche di appositi Centri di farmacovigilanza.
4. La Direzione organizza, con la partecipazione dell’Istituto superiore di sanita’, riunioni periodiche con i responsabili di farmacovigilanza presso le regioni per concordare le modalita’ operative relative alla gestione della farmacovigilanza.»;
b) l’articolo 3 e’ sostituito dal seguente: «Art. 3. – 1. Il titolare dell’autorizzazione all’immissione in commercio e’ tenuto a registrare in modo dettagliato tutte le sospette reazioni avverse da farmaci osservate in Italia, nell’Unione europea o in un Paese terzo. Il titolare dell’autorizzazione all’immissione in commercio e’ tenuto, altresi’, a registrare e a notificare immediatamente, e comunque entro quindici giorni solari da quando ne ha avuto notizia, qualunque sospetta reazione avversa grave da farmaci verificatasi in Italia segnalatagli da personale sanitario alla struttura sanitaria di appartenenza del segnalatore e, ove non fosse possibile identificare tale struttura, alla Direzione. Il titolare dell’autorizzazione all’immissione in commercio e’ tenuto, altresi’, a registrare e a notificare immediatamente, e comunque entro quindici giorni solari da quando ne ha avuto notizia, qualunque altra sospetta reazione avversa grave da farmaci di cui sia venuto a conoscenza alla Direzione. Eventuali aggiornamenti sulle segnalazioni di reazioni avverse ricevute possono essere richieste esclusivamente al Responsabile di farmacovigilanza mittente della segnalazione stessa quale il Ministero o la struttura sanitaria.
2. Il titolare dell’autorizzazione all’immissione in commercio provvede a che tutte le sospette reazioni avverse gravi ed inattese verificatesi nel territorio di un Paese terzo e segnalate da personale sanitario siano immediatamente e comunque entro quindici giorni solari da quando ne ha avuto notizia, notificate alla Direzione secondo le modalita’ previste dal comma 5, letterad).
3. Per i medicinali disciplinati dall’articolo 9, comma 3, del decreto legislativo 29 maggio 1991, n. 178, e dall’articolo 9-bis del decreto legislativo 18 febbraio 1997, n. 44, ai quali sono state applicate le procedure di mutuo riconoscimento e per i quali l’Italia e’ il Paese membro di riferimento, il titolare dell’autorizzazione all’immissione in commercio provvede inoltre a segnalare alla Direzione, secondo le modalita’ ed i tempi stabiliti in accordo con essa, qualunque sospetta reazione avversa grave verificatasi nella Comunita’ europea.
4. Il titolare dell’autorizzazione all’immissione in commercio di medicinali deve disporre, a titolo stabile e continuativo, di un responsabile del servizio di farmacovigilanza, in possesso della laurea in medicina e chirurgia o in farmacia, o in chimica e tecnologia farmaceutica, o in biologia o in chimica, ai sensi della legge 19 novembre 1990, n. 341, o rispettive lauree specialistiche di cui al decreto del Ministro dell’universita’ e della ricerca scientifica e tecnologica 3 novembre 1999, n. 509. Il responsabile del servizio di farmacovigilanza deve essere persona diversa dal responsabile del servizio scientifico previsto dall’articolo 14 del decreto legislativo 30 dicembre 1992, n. 541, e deve essere posto in condizione di usufruire di tutti i dati di tale servizio. Le competenze del responsabile si estendono a tutti i medicinali della cui autorizzazione all’immissione in commercio e’ titolare l’azienda da cui egli dipende, anche se commercializzati da altre aziende.
5. Il responsabile del servizio di farmacovigilanza assicura: a) l’istituzione e il funzionamento di un sistema atto a garantire che le informazioni su tutte le presunte reazioni avverse comunicate al personale della societa’ ed agli informatori medico-scientifici, siano raccolte, ordinate e accessibili in un unico luogo; b) che tutte le informazioni relative alla sicurezza dei prodotti, successive all’atto dell’autorizzazione siano portate rapidamente a conoscenza del personale sanitario anche tramite i contatti del servizio di informazione scientifica della propria azienda; c) l’elaborazione dei rapporti di cui al successivo comma 6, da sottoporre alle autorita’ competenti secondo le modalita’ stabilite dal Ministero della salute, che tiene conto delle indicazioni dei competenti organismi internazionali e comunitari; d) la trasmissione, secondo modalita’ stabilite dalla Direzione, per via telematica al sistema nazionale di farmacovigilanza, delle segnalazioni di sospette reazioni avverse gravi e inattese verificatesi in un Paese terzo mantenendo a disposizione le schede cartacee; e) la trasmissione alla struttura sanitaria di pertinenza delle segnalazioni di sospette reazioni avverse gravi o inattese avvenute sul territorio nazionale ricevute direttamente dal segnalatore e non tramite la rete nazionale di farmacovigilanza; f) la trasmissione, in maniera rapida ed esauriente, ad ogni richiesta della Direzione, di informazioni supplementari ai fini della valutazione dei rischi di un medicinale, comprese le informazioni riguardanti i volumi di vendita dello stesso.
6. Fatte salve eventuali altre prescrizioni che condizionano il rilascio dell’autorizzazione, e’ fatto obbligo al titolare dell’autorizzazione all’immissione in commercio di presentare alle autorita’ competenti le informazioni sulle sospette reazioni avverse in forma di rapporti periodici di aggiornamento sulla sicurezza o immediatamente su richiesta, oppure ad intervalli regolari come da schema seguente: ogni sei mesi per i primi due anni dalla data di rilascio della prima autorizzazione internazionale e successivamente ogni anno per i successivi due anni e in coincidenza del primo rinnovo dell’autorizzazione. In seguito tali rapporti periodici devono essere presentati ogni cinque anni congiuntamente alla domanda di rinnovo dell’autorizzazione. Essi devono contenere una valutazione scientifica dei benefici e dei rischi del medicinale in questione.
Dopo il rilascio dell’autorizzazione all’immissione in commercio il titolare puo’ chiedere una modifica dei tempi specificati nel presente articolo, conformemente alla procedura stabilita nel regolamento (CE) n. 541/95 della Commissione. I rapporti periodici di aggiornamento sulla sicurezza – PSUR – sono presentati secondo la scadenza prevista, sulla base delle modalita’ stabilite dalla Direzione.
7. Le Aziende titolari di autorizzazioni all’immissione in commercio comunicano al Ministero della salute, ufficio di farmacovigilanza, qualsiasi iniziativa adottata da altri competenti organismi sui propri prodotti per motivi di sicurezza, prima che tali interventi siano resi di dominio pubblico.
8. E’ fatto obbligo al titolare dell’autorizzazione all’immissione in commercio di diffondere ai medici prescrittori le note informative e gli aggiornamenti sulla sicurezza dei farmaci, secondo indicazioni, tempi e modalita’ stabilite dalla Direzione, ogni qualvolta emergano nuove informazioni relative al profilo di tollerabilita’ del prodotto.
9. Le aziende titolari di autorizzazioni all’immissione in commercio di farmaci sono tenute a trasmettere trimestralmente per via informatica i dati di vendita delle specialita’ medicinali utilizzando la procedura prevista dal decreto dirigenziale in data 24 maggio 2002 pubblicato nella Gazzetta Ufficiale n. 132 del 7 giugno 2002.
10. L’obbligo previsto al comma 9 e’ esteso alle aziende responsabili della commercializzazione dei medicinali.
11. Il Ministero della salute, in caso di violazione delle aziende farmaceutiche degli obblighi previsti dal presente articolo puo’ adottare ulteriori azioni amministrative in relazione alla gravita’ della violazione riscontrata e della sua reiterazione.»;
c) l’articolo 4 e’ sostituito dal seguente: «Art. 4. – 1. Le strutture sanitarie – Aziende unita’ sanitarie locali, Aziende ospedaliere, Istituti di ricovero e cura a carattere scientifico – devono nominare un responsabile di farmacovigilanza della struttura che provvede a registrarsi alla rete nazionale di farmacovigilanza al fine dell’abilitazione necessaria per la gestione delle segnalazioni. Le strutture sanitarie private, al fine di assolvere ai compiti di farmacovigilanza, fanno riferimento al responsabile di farmacovigilanza della Azienda unita’ sanitaria locale competente per territorio.
2. I medici e gli altri operatori sanitari sono tenuti a segnalare tutte le sospette reazioni avverse gravi o inattese di cui vengano a conoscenza nell’ambito della propria attivita’. Vanno comunque segnalate tutte le sospette reazioni avverse osservate, gravi, non gravi, attese ed inattese da tutti i vaccini e da farmaci posti sotto monitoraggio intensivo ed inclusi in elenchi pubblicati periodicamente dal Ministero della salute.
3. Il presente decreto non si applica alle segnalazioni di reazioni avverse verificatesi in corso di sperimentazione clinica.
4. I medici e gli altri operatori sanitari devono trasmettere le segnalazioni di sospette reazioni avverse, tramite l’apposita scheda, tempestivamente, al Responsabile di farmacovigilanza della struttura sanitaria di appartenenza. I medici e gli altri operatori sanitari operanti in strutture sanitarie private devono trasmettere le segnalazioni di sospette reazioni avverse, tramite l’apposita scheda, tempestivamente, al Responsabile di farmacovigilanza della ASL competente per territorio, direttamente o, nel caso di cliniche o case di cura, tramite la Direzione sanitaria. I Responsabili di farmacovigilanza provvedono, previa verifica della completezza e della congruita’ dei dati, all’inserimento della segnalazione nella banca dati della rete di farmacovigilanza nazionale e alla verifica dell’effettivo inoltro del messaggio, relativo all’inserimento, alla regione ed alla azienda farmaceutica interessata. In caso di impossibilita’ di trasmissione del messaggio, ai destinatari che non e’ stato possibile raggiungere per via telematica, le strutture sanitarie invieranno copia della segnalazione riportante il codice numerico rilasciato dal sistema.
5. L’inserimento in rete va effettuato a cura del Responsabile di farmacovigilanza della struttura sanitaria entro e non oltre 7 giorni solari dal ricevimento della segnalazione. Le schede originali di segnalazione saranno conservate presso la struttura sanitaria che le ha ricevute ed inoltrate in copia al Ministero della salute, alla regione di appartenenza o al Centro di farmacovigilanza individuato dalla regione ove dagli stessi richiesto.
6. Eventuali aggiornamenti delle sospette reazioni avverse possono essere richiesti al segnalatore unicamente dal Responsabile di farmacovigilanza della struttura sanitaria di appartenenza o da un suo delegato, o da personale del Ministero della salute. Il richiedente provvede ad inserire in rete i dati acquisiti aggiornando la scheda inserita. Il responsabile di farmacovigilanza e’ comunque tenuto ad acquisire dal segnalatore una relazione clinica dettagliata, da trasmettere al Ministero della salute entro quindici giorni solari, per tutti i casi di reazioni avverse ad esito fatale.
7. La Direzione provvede affinche’ tutte le segnalazioni di sospette reazioni avverse gravi da farmaci verificatesi sul territorio nazionale siano immediatamente messe a disposizione del titolare dell’autorizzazione all’immissione in commercio e comunque entro quindici giorni solari dalla data di ricevimento della comunicazione. 8. La Direzione provvede altresi’ affinche’ tutte le segnalazioni di sospette reazioni avverse gravi da farmaci verificatesi nel territorio nazionale siano messe a disposizione dell’Agenzia e degli altri Stati membri entro quindici giorni solari dalla data di ricevimento della loro comunicazione.
9. La Direzione fornisce immediatamente all’Agenzia ed ai centri nazionali di farmacovigilanza degli altri Stati membri ed al titolare dell’autorizzazione all’immissione in commercio, informazioni su eventuali modifiche, sospensioni o revoche dell’autorizzazione di un medicinale determinate da motivi di tutela della salute pubblica. In caso di sospensione determinata da motivi di urgenza, l’informazione all’Agenzia, alla Commissione e agli altri Stati membri deve essere trasmessa entro il giorno lavorativo seguente.»;
d) l’articolo 11 e’ sostituito dal seguente: «Art. 11. – 1. Il titolare dell’autorizzazione all’immissione in commercio di specialita’ medicinali che viola gli obblighi previsti dall’articolo 3, e’ soggetto alla sanzione del pagamento da Euro 30.000 a Euro 180.000. L’importo della sanzione e’ incrementato di una quota variabile dallo 0,1 per cento all’1 per cento del fatturato della specialita’ medicinale per la quale e’ stata riscontrata la violazione. 2. Il titolare dell’autorizzazione all’immissione in commercio di specialita’ medicinali che viola gli obblighi previsti dall’articolo 3, e’ altresi’ obbligato, in caso di notizie di rilevante interesse per i pazienti, a pubblicare, a proprie spese, per tre giorni consecutivi sui principali quotidiani nazionali rettifiche, concordate con il Ministero della salute, di informazioni precedentemente diffuse. 3. Il responsabile di farmacovigilanza dell’Azienda farmaceutica che viola gli obblighi dell’articolo 3, comma 5, e’ soggetto alla sanzione del pagamento della somma da Euro 20.000 a Euro 120.000.
4. Chiunque viola l’obbligo previsto dall’articolo 3, comma 10, e’ soggetto alla sanzione del pagamento della somma da Euro 10.000 a Euro 60.000.
5. L’inosservanza delle disposizioni previste, per i responsabili di farmacovigilanza delle strutture sanitarie, comporta l’instaurazione nelle sedi competenti, di procedimenti per l’erogazione di sanzioni disciplinari, secondo le norme legislative e convenzionali.».
Art. 2.
1. Ai fini del presente decreto si fa riferimento alle definizioni riportate nell’allegato 1 che fa parte integrante del presente decreto.
Art. 3.
1. In relazione a quanto disposto dall’articolo 117, quinto comma, della Costituzione, le disposizioni del presente decreto afferenti a materie di competenza legislativa delle regioni e delle province autonome di Trento e di Bolzano, che non abbiano ancora provveduto al recepimento della direttiva 2000/38/CE della Commissione, del 5 giugno 2000, si applicano fino alla data di entrata in vigore della normativa di attuazione di ciascuna regione e provincia autonoma, nel rispetto dei vincoli derivanti dall’ordinamento comunitario e dei principi fondamentali desumibili dal presente decreto.
Art. 4.
1. Il decreto del Presidente della Repubblica 25 gennaio 1991, n. 93, recante regolamento di esecuzione delle disposizioni di cui all’articolo 9 del decreto-legge 30 ottobre 1987, n. 443, convertito, con modificazioni, dalla legge 29 dicembre 1987, n. 531, sulle modalita’ di attuazione della farmacovigilanza attraverso le strutture pubbliche, e’ abrogato.
ALLEGATO 1
GLOSSARIO
Abuso di medicinali
L’uso volontario ed eccessivo, prolungato o sporadico, di medicinali correlato ad effetti dannosi sul piano fisico o psichico.
Farmacovigilanza: E’ l’insieme delle attivita’ il cui obbiettivo e’ quello di fornire, in modo continuativo, le migliori informazioni possibili sulla sicurezza dei farmaci permettendo cosi’ l’adozione delle misure opportune e in tal modo assicurare che i farmaci disponibili sul mercato presentino, nelle condizioni di utilizzo autorizzate, un rapporto beneficio rischio favorevole per la popolazione. Le informazioni sui rischi associati ai farmaci possono derivare da diverse fonti quali:
a) Segnalazioni spontanee di singoli casi di sospette reazioni avverse da parte di operatori sanitari; b) Studi post-autorizzazione che comprendono gli studi farmacoepidemiologici;
c) Banche dati sanitarie informatizzate;
d) Informazione pre-clinica di sperimentazioni animali e informazioni dalle ricerche cliniche su un farmaco;
e) Informazioni inerenti la fabbricazione, la conservazione, la vendita, la distribuzione, la dispensazione, i modelli di utilizzo, prescrizione e somministrazione ai pazienti di un farmaco;
f) Letteratura medica;
g) Altre fonti di informazione come quelle relative all’utilizzo scorretto e all’abuso dei farmaci che possano ripercuotersi sulla valutazione dei benefici e dei rischi dei farmaci; h) Altre autorita’ sanitarie e organismi sanitari nazionali e internazionali.
Rapporto periodico sulla sicurezza (Periodic safety updated report. PSUR): il rapporto, redatto a cura delle Aziende titolari della autorizzazione all’immissione in commercio dei farmaci, che contiene le informazioni di cui all’art. 3 comma 6 del presente decreto legislativo.
Reazione avversa: risposta ad un farmaco che sia nociva e non intenzionale e che avvenga alle dosi normalmente usate nell’uomo per la profilassi, la diagnosi, la terapia o per ripristinare, correggere o modificare le funzioni fisiologiche.
Reazione avversa grave: qualsiasi reazione che provoca la morte di un individuo, ne mette in pericolo la vita, ne richiede o prolunga l’ospedalizzazione, provoca disabilita’ o incapacita’ persistente o significativa, comporta una anomalia congenita o un difetto alla nascita.
Reazione avversa inattesa: reazione avversa la cui natura, gravita’ o conseguenza non e’ coerente con il riassunto delle caratteristiche del prodotto.
Sistema di segnalazione spontanea: metodo di farmacovigilanza basato sulla comunicazione, raccolta e valutazione di segnalazioni di sospette reazioni avverse a farmaci, osservate da un operatore sanitario.
Sperimentazione clinica: qualsiasi indagine effettuata su soggetti umani volta a scoprire o verificare gli effetti clinici, farmacologici e/o gli altri effetti farmacodinamici di uno o piu’ medicinali in fase di sperimentazione e/o ad individuare qualsiasi tipo di reazione avversa nei confronti di uno o piu’ medicinali in fase di sperimentazione, e/o a studiarne l’assorbimento, la distribuzione, il metabolismo e l’eliminazione al fine di accertarne l’innocuita’ e/o l’efficacia. Tale sperimentazione include la sperimentazione clinica effettuata in un unico sito o in piu’ siti in un unico Stato membro o in piu’ Stati membri.
Alla sperimentazione clinica si applica la direttiva 2001/20/CE del 4 aprile 2001.
Studio post-autorizzazione: qualsiasi studio condotto durante la commercializzazione di un farmaco secondo le condizioni della sua scheda tecnica autorizzata o in condizioni normali di utilizzo;
Studio post-autorizzazione sulla sicurezza: studio farmacoepidemiologico o ricerca clinica condotto in conformita’ con le disposizioni dell’autorizzazione alla commercializzazione e realizzato al fine d’identificare o quantificare i rischi associati ai farmaci autorizzati;
Bozza dicembre 2002
FARMACOVIGILANZA
Fonti normative.
Decreto del Presidente della Repubblica 25 gennaio 1991, n. 93, Regolamento di esecuzione delle disposizioni di cui all’art. 9 del decreto-legge 30 ottobre 1987, n. 443, convertito, con modificazioni, dalla legge 29 dicembre 1987, n. 531, sulle modalita’ di attuazione della farmacovigilanza attraverso le strutture pubbliche.
Decreto 20 aprile 1991, pubblicato nella Gazzetta Ufficiale n. 133 dell’8 giugno 1991. Approvazione dei modelli di schede e dello schema di relazione previsti dal decreto del Presidente della Repubblica 25 gennaio 1991, n. 93, recante il regolamento di esecuzione delle disposizioni di cui all’art. 9 del decreto-legge 30 ottobre 1987, n. 443, convertito, con modificazioni, dalla legge 29 dicembre 1987, n. 531, sulle modalita’ di attuazione della farmacovigilanza attraverso le strutture pubbliche.
Circolare 29 aprile 1993, n. 12-bis Farmacovigilanza: aspetti applicativi del decreto del Presidente della Repubblica n. 93 del 25 gennaio 1991.
Decreto legislativo 18 febbraio 1997, n. 44, Attuazione della direttiva 93/39/CEE che modifica le direttive 65/65/CEE, 75/318/CEE, 75/319/CEE relative ai medicinali.
Circolare n. 12 del 24 settembre 1997 Note esplicative al decreto legislativo 18 febbraio 1997, n. 44: «Attuazione della direttiva 93/39/CEE che modifica le direttive 65/65/CEE, 75/318/CEE, 75/319/CEE relative ai medicinali».
Decreto 7 agosto 1997 pubblicato nella Gazzetta Ufficiale n. 210 del 9 settembre 1997.
Sostituzione del modello A allegato al decreto ministeriale 20 aprile 1991, recante Approvazione dei modelli di schede e dello schema di relazione previsti dal decreto del Presidente della Repubblica 25 gennaio 1991, n. 93, recante il regolamento di esecuzione delle disposizioni di cui all’art. 9 del decreto-legge 30 ottobre 1987, n. 443, convertito, con modificazioni, dalla legge 29 dicembre 1987, n. 531, sulle modalita’ di attuazione della farmacovigilanza attraverso le strutture pubbliche.
Circolare n. 15 del 29 settembre 1999 – Integrazione alla circolare n. 12 del 24 settembre 1997 – Trasmissione delle segnalazioni di reazioni avverse.
***PER MAGGIORI INFO***
http://www.usl8.toscana.it/index.php/aree-tematiche/farmaci
Dal luglio 2012 è attiva anche in Italia la nuova legislazione europea di farmacovigilanza che permette ai pazienti di fare direttamente le segnalazioni via web, ma chissà se tutti segnalano direttamente e se il sistema di segnalazione funziona..
SEGNALAZIONE REAZIONI AVVERSE DA FARMACI
http://www.torrinomedica.it/studio/adr/denuncia_reazione_avversa.asp#axzz2Dvr5eUny














 “… Dalla
“… Dalla