FARMACI RITIRATI DAL COMMERCIO e/o OGGETTO DI MONITORAGGIO
Farmaci Ritirati dal Commercio e/o Oggetto di Monitoraggio
Quarta Parte
.Comunicazione EMA sulle restrizioni d’uso per i medicinali a base di
Tiocolchicoside (22/11/2013)
Il Comitato per i prodotti medicinali per uso umano (CHMP) dell’Agenzia Europea dei Medicinali ha raccomandato restrizioni agli usi autorizzati dei medicinali a base di tiocolchicoside per uso orale o iniettabile in tutta l’Unione europea (UE).

Questi medicinali sono oggi raccomandati solo come trattamento addizionale per contratture muscolari dolorose (contrazione permanente del tessuto muscolare) derivanti da condizioni patologiche della colonna vertebrale in adulti e adolescenti di età superiore a 16 anni. Inoltre, la dose di tiocolchicoside per bocca o per iniezione deve essere limitata.
Il Thiocolchicoside è un rilassante muscolare autorizzato con procedura nazionale in diversi Stati membri dell’UE1 per uso orale o intramuscolare nel trattamento di patologie muscolari dolorose.
La rivalutazione dei medicinali a base di tiocolchicoside è stata avviata su richiesta dell’Agenzia Italiana del Farmaco (AIFA) a seguito di nuove evidenze sperimentali che suggerivano che il metabolismo di tiocolchicoside desse origine nell’organismo ad un metabolita chiamato M2 o SL59.0955, il quale può causare danni alle cellule in divisione causando aneuploidia (cioè un numero o una disposizione di cromosomi anormali).
Di conseguenza, l’AIFA ha chiesto al CHMP di esaminare il profilo di sicurezza del medicinale e di considerare quali azioni regolatorie intraprendere……………
per continuare a leggere la COMUNICAZIONE EMA clicca il seguente link
http://www.agenziafarmaco.gov.it/sites/default/files/Tiocolchicoside_PR_22%20novembre_rev%202013.pdf
Per maggiori informazioni:
vai al sito dell’Ema
http://www.ema.europa.eu/ema/
contatta l’Ufficio di Farmacovigilanza
riportata qui di seguito tramite link
http://www.agenziafarmaco.gov.it/it/content/comunicazione-ema-su-restrizioni-d’uso-i-medicinali-base-di-tiocolchicoside-22112013
.Nota Informativa Importante sui medicinali a base di Tiocolchicoside (07/02/2014)
Importanti limitazioni relative all’uso dei medicinali a base di tiocolchicoside per uso sistemico sono state imposte a seguito dei risultati derivanti dalla revisione di nuovi dati preclinici che hanno sollevato dubbi sull’attività di un metabolita di tiocolchicoside sui cromosomi.
Pertanto è necessario adottare misure precauzionali per ridurre l’esposizione al metabolita SL59.0955 delle formulazioni sistemiche (le formulazioni topiche non producono concentrazioni sistemiche significative del metabolita e non sono interessate da queste raccomandazioni).
per continuare a leggere qui…
http://www.agenziafarmaco.gov.it/it/content/nota-informativa-importante-sui-medicinali-base-di-tiocolchicoside-07022014
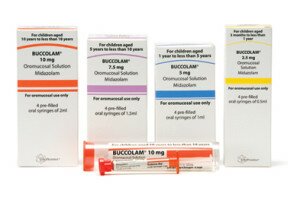
L’Aifa ha disposto il ritiro precauzionale del medicinale destinato a bambini e adolescenti per il trattamento delle crisi convulsive acute e prolungate. Il farmaco potrebbe essere stato contaminato da un antitumorale. Ecco i consigli da seguire per farmacisti, medici e pazienti.
Ritirato in via precauzionale il farmaco Buccolam, usato per le crisi convulsive acute e prolungate in bambini e ragazzi, dai 3 mesi ai 18 anni. Lo ha deciso l’Aifa, l’Agenzia italiana del farmaco, secondo la quale – a seguito di un controllo nella fabbrica di produzione – c’è la probabilità che il medicinale sia stato contaminato con un antitumorale (amsacrina). A oggi, tuttavia, non sono stati segnalati casi riconducibili alla potenziale contaminazione.
Cosa fare in caso di dubbi
Mentre le verifiche sono ancora in corso, l’Aifa raccomanda alle farmacie di non vendere più il Buccolam e ai medici di prescrivere, in alternativa, il Micropam, a base di diazepam.
Per qualsiasi dubbio, chiama il numero verde Aifa “Farmaci-line”: 800 571661 (dal lunedì al venerdì escluse le festività, 9-13 e 14-16; mail: [email protected]).
http://www.altroconsumo.it/salute/farmaci/attenzione-a/ritirato-il-buccolam
ALTRA FONTE
Ritirato a scopo precauzionale il Buccolam
Il 15/04/2013 l’AIFA ha disposto per l’Italia il ritiro del medicinale BUCCOLAM come misura precauzionale in quanto nel sito di produzione “è stato identificato un potenziale rischio di contaminazione di BUCCOLAM con un altro prodotto medicinale (amsacrina, un farmaco antineoplastico).“
Quindi le farmacie non potranno più venderlo al pubblico e ne dovranno attendere il ritiro da parte della società distributrice.
Ad oggi però si tratta di un “rischio potenziale” in quanto i controlli effettuati non hanno dimostrato una effettiva contaminazione e comunque non sono stati segnalati eventi avversi al Buccolam che potrebbero fare pensare a contaminazione da Amsacrina
L’AIFA ha pertanto pubblicato una “Nota informativa importante”, informando di ciò operatori e utilizzatori e invita, almeno per il momento, ad utilizzare in caso di necessità un farmaco alternativo, ad esempio il MICROPAM.
fonte riportata di seguito
http://www.medisoc.it/ritirato-a-scopo-precauzionale-il-buccolam/
Nota Informativa Importante sul ritiro precauzionale del medicinale Buccolam (15/04/2014)
.LINK ULTIME NOTIZIE SANITARIE
dalla fonte riportata di seguito ecco a voi una tabella statistica sull’andamento dei ritiri e monitoraggio vario dei farmaci…
http://www.torrinomedica.it/studio/news.asp#axzz34wDRdqRQ
e anche qui…
http://www.agenziafarmaco.gov.it/it/content/nota-informativa-importante-sul-ritiro-precauzionale-del-medicinale-buccolam-15042014
(tutte le fonti citate e sottolineate sono raggiungibili o cliccando 2 volte nel motore di ricerca o più semplicemente copiandole nella barra)
-
Avastin nella lista dei farmaci di uso consolidato per la degenerazione maculare senile
9/6/2014La Commissione Tecnico Scientifica (CTS) dell’AIFA, nel corso nella seduta del 9 e 10 giugno, si è espressa a favore …
-
Dichiarazione AIFA su accertamenti
27/5/2014In merito alle notizie comparse a mezzo stampa di accertamenti in corso presso l’Agenzia Italiana del Farmaco, l’AIFA rende ..
- Note informative importanti
-
Nota Informativa Importante su Fentanil cerotto transdermico (16/06/2014)
9/6/2014L’Agenzia Italiana del Farmaco, in accordo con l’Agenzia Europea dei Medicinali (EMA), rende disponibili importanti …
-
Nota Informativa Importante su Procoralan/Corlentor (11/06/2014)
9/6/2014L’Agenzia Italiana del Farmaco, in accordo con l’Agenzia Europea dei Medicinali (EMA), rende disponibili importanti …
-
Nota Informativa Importante su ketoprofene (06/06/2014)
6/6/2014L’Agenzia Italiana del Farmaco, in accordo con l’Agenzia Europea dei Medicinali (EMA), rende disponibili importanti …
-
Nota Informativa Importante su budesonide (28/05/2014)
28/5/2014L’Agenzia Italiana del Farmaco, rende disponibili nuove ed importanti informazioni di sicurezza sui medicinali contenenti …
-
Nota Informativa Importante su Invirase (saquinavir) (26/05/2014)
23/5/2014L’Agenzia Italiana del Farmaco, in accordo con l’Agenzia Europea dei Medicinali, rende disponibili nuove ed importanti …
-
Nota Informativa Importante su Crixivan (12/05/2014)
9/5/2014L’Agenzia Italiana del Farmaco, in accordo con l’Agenzia Europea dei Medicinali, rende disponibili nuove ed importantii …
-
Nota Informativa Importante sui prodotti falsificati etichettati come Herceptin (trastuzumab) (07/05/2014)
5/5/2014L’Agenzia Italiana del Farmaco rende disponibili nuove ed importanti informazioni sui prodotti falsificati, originariamente …
-
Nota Informativa Importante su Herceptin (18/04/2014)
18/4/2014L’Agenzia Italiana del Farmaco rende disponibili nuove ed importanti informazioni sul caso riguardante il furto e successivo …
-
Nota Informativa Importante sul ritiro precauzionale del medicinale Buccolam (15/04/2014)
15/4/2014L’Agenzia Italiana del Farmaco rende disponibili nuove ed importanti informazioni sul ritiro precauzionale del medicinale …
-
Nota Informativa Importante su declino del titolo anticorpale dopo vaccinazione con Mencevax ACWY (15/04/2014)
15/4/2014L’Agenzia Italiana del Farmaco rende disponibili nuove ed importanti informazioni circa i dati clinici disponibili sulla …
-
Carenza Tetravac – modalità di richiesta d’importazione dall’estero (17/06/2014)
17/6/2014L’Agenzia Italiana del Farmaco rende disponibili online aggiornamenti relativi al medicinale “Tetravac”, non …
-
Carenza Fsme Immun – modalità di richiesta d’importazione dall’estero (09/06/2014)
9/6/2014L’Agenzia Italiana del Farmaco rende disponibili online aggiornamenti relativi al medicinale “FSME-IMMUN 0,5 e 0,25 ml”, …
-
Carenza Xalkori (crizotinib) – modalità di richiesta d’importazione dall’estero (30/05/2014)
30/5/2014L’Agenzia Italiana del Farmaco rende disponibili online aggiornamenti relativi al medicinale “Xalkori (crizotinib) …
-
Carenza Haemocomplettan (fibrinogeno da plasma umano) – modalità di richiesta d’importazione dall’estero (19/05/2014)
19/5/2014L’Agenzia Italiana del Farmaco rende disponibili aggiornamenti relativi al medicinale “Haemocomplettan” (fibrinogeno da plasma …
-
Determinazioni n. 425-427 del 18 aprile 2014 (14/05/2014)
14/5/2014L’Agenzia Italiana del Farmaco rende disponibili le Determinazioni n. 425-427 del 18 aprile 2014 riguardanti la …
-
Comunicazione EMA sulla revisione dei medicinali contenenti ibuprofene (13/06/2014)
13/6/2014Il Comitato di Valutazione dei rischi per la farmacovigilanza (PRAC) ha iniziato una revisione per valutare il rischio …
-
Comunicato stampa EMA sulla valutazione relativa al sito di produzione Ranbaxy di Toansa (05/06/2014)
5/6/2014Le autorità regolatorie europee hanno concluso la valutazione relativa al sito di produzione Ranbaxy di Toansa. Non sono …
-
Comunicato stampa EMA su Avastin e MabThera (03/06/2014)
3/6/2014L’Agenzia Europea per i medicinali rende disponibili ultimi aggiornamenti relativi ad (Avastin e MabThera), identificati come …
-
Comunicazione EMA su farmaci che agiscono sul (RAS) (23/05/2014)
23/5/2014Il Comitato dell’Agenzia Europea per i Medicinali per Uso Umano (CHMP) ha approvato le restrizioni alla combinazione di diverse …
-
Comunicazione EMA su Idrossizina (09/05/2014)
9/5/2014L’Agenzia Europea dei Medicinali ha avviato una revisione dei medicinali contenenti idrossizina.
.RITIRO DEL MUSCORIL
Rischio AIFA Cancro e Sterilità per chi usa il Muscoril, Relmus, Muscoflex e altri 7 farmaci noti. Ecco quali e i dosaggi!

L’ Aifa, l’ agenzia italiana del farmaco, in una nota informativa precisa i potenziali rischi prodotti dal principio attivo contenuto nel farmaco Muscoril che “se assunto costantemente, provoca un rischio di teratogenicità, embriofetotossicità/aborto spontaneo, compromissione della fertilità maschile e come potenziale fattore di rischio di cancro”. La stessa agenzia, infatti, consiglia un dosaggio limitato.
Il medicinale non deve, quindi, essere usato per il trattamento a lungo termine di condizioni croniche ma deve essere limitato a 7 giorni per le formulazioni orali, e a 5 giorni, per quelle iniettabili. Inoltre la posologia non deve superare la dose di 8 mg ogni 12 ore, per le formulazioni orali, e di 4 mg ogni 12 ore per quelle iniettabili.
Il Muscoril, come gli altri medicinali prodotti ad hoc, è solitamente prescritto per alleviare dolori muscolari, dolorose contratture, associate a patologie acute della colonna, negli adulti e negli adolescenti di età superiore a 16 anni.
In pratica, quello che succede nell’organismo è che il tiocolchicoside si trasforma in una sostanza che può causare danni alle cellule: tecnicamente si tratta dell’aneuploidia, cioè un’anormalità cromosomica che a sua volta può determinare i rischi di cui abbiamo scritto. Ecco quali sono i farmaci che contengono questo principio attivo e che sono in vendita in Italia.
- Decontril
- Miorexil
- Miotens
- Moveril
- Muscoflex
- Muscoril
- Relmus
- Sciomir
- Strialisin
- Teraside
- Tioside
- Tiocolchicoside generici-equivalenti di varie marche
fonte reperibile di seguito..
http://www.retenews24.it/rtn24/salute-benessere/allarme-aifa-cancro-e-sterilita-per-chi-usa-il-muscoril-relmus-muscoflex-e-altri-10-farmaci-noti-ecco-quali-e-i-dosaggi/
Cautela con i farmaci per dolori muscolari

I medicinali, in compresse e fiale, usati come rilassanti muscolari e che contengono tiocolchicoside potrebbero causare danni alle cellule e quindi infertilità negli uomini e problemi ai neonati, se assunti da donne in gravidanza. Questi farmaci, tra cui il Muscoril o il Miorexil, vanno usati solo a basse dosi e per brevi periodi.
Attenzione ai farmaci per contratture muscolari che contengono tiocolchicoside: secondo un’allerta dell’Ema, l’Agenzia europea dei medicinali, quelli in forma di compresse e di fiale iniettabili (escluse quindi le creme e le schiume) se usati per periodi lunghi potrebbero comportare un danno per le cellule e provocare infertilità negli uomini e danni ai feti in via di sviluppo. C’è anche l’ipotesi – non ancora provata – di rischio cancro.
I medicinali in compresse e fiale interessati
In pratica, quello che succede nell’organismo è che il tiocolchicoside si trasforma in una sostanza che può causare danni alle cellule: tecnicamente si tratta dell‘aneuploidia, cioè un’anormalità cromosomica che a sua volta può determinare i rischi di cui abbiamo scritto.
Cosa fare
Bisogna avere grande cautela con questi medicinali, non superando le dosi consigliate e usandoli per poco tempo. Queste le indicazioni per un uso sicuro.
- Devono essere usati come terapia addizionale nel trattamento delle contratture muscolari, cioè solo in associazione ad un altro farmaco (di solito un antidolorifico).
- Non bisogna prendere le compresse per più di 7 giorni.
- Le iniezioni intramuscolari non devono essere ripetute per più di 5 giorni di seguito.
- Non devono essere usati sotto i 16 anni e in donne in gravidanza o che allattano.
- Non devono essere usati per trattare le patologie croniche.
Per trovare tutte le informazioni che ti interessano sui farmaci consulta il nostro servizio online. Ti aiutiamo anche a trovare gli equivalenti più economici, ma egualmente efficaci.
fonte reperibile di seguito
http://www.altroconsumo.it/salute/farmaci/attenzione-a/farmaci-tiocolchicoside
Vaccini Informa
Riproduzione consentita purché l'articolo non sia modificato in nessuna parte, indicando Autore e link attivo al sito.



There are no comments at the moment, do you want to add one?
Scrivi un commento